It wichtichste ferskil tusken nitraat en nitriet is dat nitraat trije soerstofatomen befettet bûn oan in stikstofatoom, wylst nitrit twa soerstofatomen befettet bûn oan in stikstofatom.
Sawol nitrate as nitrit binne anorganyske anionen besteande út stikstof- en soerstofatomen.Beide dizze anionen hawwe in -1 elektryske lading.Se komme benammen foar as it anion fan sâltferbiningen.Der binne wat ferskillen tusken nitraat en nitrit;wy sille dizze ferskillen besprekke yn dit artikel.
Wat is Nitraat?
Nitraat is in anorganysk anion mei de gemyske formule NO3–.It is in polyatomic anion dat hat 4 atomen;ien stikstofatom en trije soerstofatomen.De anion hat -1 totale lading.De molêre massa fan dit anion is 62 g / mol.Ek dit anion is ôflaat fan syn konjugearre soer;nitric acid of HNO3.Mei oare wurden, nitraat is de konjugatbasis fan it salpetersûr.
Koartsein, nitraat-ion hat ien stikstofatoom yn it sintrum dat bynt mei trije soerstofatomen fia kovalente gemyske bining.By it beskôgjen fan de gemyske struktuer fan dit anion, hat it trije identike NO-bindingen (neffens de resonânsjestruktueren fan it anion).Dêrtroch is de mjitkunde fan it molekule trigonaal planar.Elk soerstofatom draacht in − 2⁄3 lading, wat de totale lading fan it anion as -1 jout.
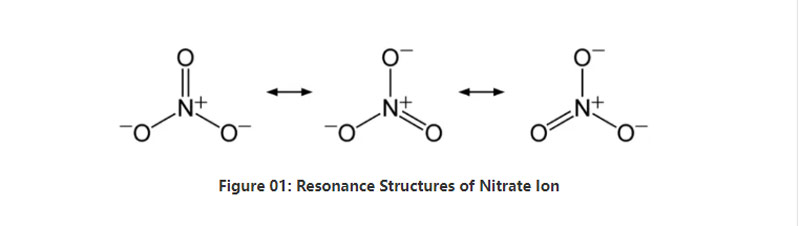
By standertdruk en temperatuer lost hast alle sâltferbiningen mei dit anion yn wetter op.Wy kinne natuerlik foarkommende nitraat sâlten op ierde fine as ôfsettings;nitratine ôfsettings.It befettet benammen natriumnitraat.Boppedat kinne nitrifisearjende baktearjes nitraat-ion produsearje.Ien fan 'e wichtichste gebrûk fan' e nitraatsâlten is yn 'e produksje fan dongstoffen.Fierder is it nuttich as oksidaasjemiddel yn eksplosiven.
Wat is Nitrit?
Nitrit is in anorganysk sâlt mei de gemyske formule NO2-.Dit anion is in symmetrysk anion, en it hat ien stikstofatom bûn oan twa soerstofatomen mei twa identike NO-kovalente gemyske obligaasjes.Dêrtroch is it stikstofatoom yn it sintrum fan it molekule.De anion hat -1 totale lading.
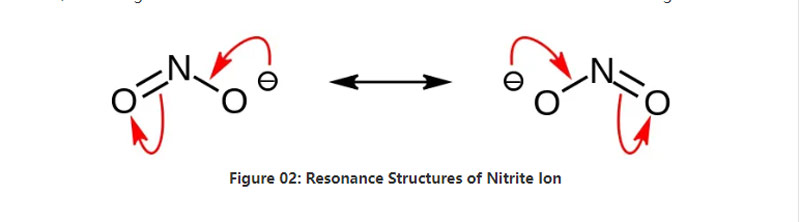
De molêre massa fan it anion is 46,01 g/mol.Ek dit anion is ôflaat fan it salpeterzuur of HNO2.Hjirtroch is it de konjugatbasis fan it salpetersûr.Dêrom kinne wy nitritsâlten yndustrieel produsearje fia it trochjaan fan nitreuze dampen yn wetterige natriumhydroxide-oplossing.Boppedat produsearret dit natriumnitrit dat wy kinne suverje fia herkristallisaasje.Fierder binne nitritsâlten lykas natriumnitrit nuttich yn it behâld fan iten, om't it iten kin foarkomme fan mikrobiële groei.
Wat is it ferskil tusken nitraat en nitriet?
Nitraat is in anorganysk anion mei de gemyske formule NO3– wylst Nitrit in anorganysk sâlt is mei de gemyske formule NO2–.Dêrom leit it primêre ferskil tusken nitraat en nitrit op 'e gemyske gearstalling fan' e twa anionen.Dat is;it wichtichste ferskil tusken nitraat en nitriet is dat nitraat trije soerstofatomen befettet bûn oan in stikstofatoom, wylst nitrit twa soerstofatomen befettet bûn oan in stikstofatom.Boppedat, nitrate ion is ôflaat fan syn konjugate soer;it salpetersûr, wylst it nitrition ôflaat is fan salpetersûr.As in oar wichtich ferskil tusken nitraat- en nitrit-ionen, kinne wy sizze dat nitrate in oksidaasjemiddel is, om't it de ienige reduksje kin ûndergean, wylst nitrit kin fungearje as sawol oksidearjend as reduksjemiddel.
Post tiid: mei-16-2022





